MINI REVISIÓN
La avanzada contra el cáncer: marcadores universales exclusivos del cáncer
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, China;2 Departamento de Cirugía General, Primer Hospital Afiliado de la Universidad Médica de Harbin, Harbin 150001, China;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, China;4 Hospital Popular de la Región Autónoma Hui de Ningxia, Universidad Médica de Ningxia, Yinchuan 750002, China;5Centro Clínico de Salud Pública de Shanghai y Departamento de Cirugía General, Hospital Huashan e Instituto de Metástasis del Cáncer y Laboratorio de Epigenética de ARN, Institutos de Ciencias Biomédicas, Facultad de Medicina de Shanghai, Universidad de Fudan, Shanghai 200032, China
ABSTRACTO
El cáncer es la principal causa de muerte en todo el mundo.La detección temprana del cáncer puede reducir la mortalidad de todos los tipos de cáncer;sin embargo, faltan biomarcadores eficaces de detección temprana para la mayoría de los tipos de cáncer.La metilación del ADN siempre ha sido un objetivo importante de interés porque la metilación del ADN generalmente ocurre antes que otros cambios genéticos detectables.Mientras se investigan las características comunes del cáncer utilizando una nueva guía de secuenciación de posicionamiento para la metilación del ADN, una serie de marcadores universales exclusivos del cáncer (UCOM) han surgido como fuertes candidatos para la detección temprana eficaz y precisa del cáncer.Si bien el valor clínico de los biomarcadores de cáncer actuales se ve disminuido por la baja sensibilidad y/o la baja especificidad, las características únicas de los UCOM garantizan resultados clínicamente significativos.La validación del potencial clínico de las UCOM en cánceres de pulmón, cuello uterino, endometrio y urotelial respalda aún más la aplicación de las UCOM en múltiples tipos de cáncer y diversos escenarios clínicos.De hecho, las aplicaciones de las UCOM se encuentran actualmente bajo investigación activa con mayor evaluación en la detección temprana del cáncer, diagnóstico auxiliar, eficacia del tratamiento y seguimiento de la recurrencia.Los mecanismos moleculares mediante los cuales los UCOM detectan cánceres son los siguientes temas importantes a investigar.La aplicación de UCOM en escenarios del mundo real también requiere implementación y perfeccionamiento.
PALABRAS CLAVE
Detección de cáncer;la detección del cáncer;metilación del ADN;epigenética del cáncer;biomarcadores de cáncer
¿Por qué necesitamos urgentemente nuevos? ¿biomarcadores?
Después de luchar contra el cáncer durante más de un siglo, el cáncer sigue siendo la amenaza biológica más letal para la humanidad.El cáncer sigue siendo un problema de salud mundial, con 19,3 millones de casos nuevos y casi 10 millones de muertes estimadas en 20201. En 2020, se estima que se diagnosticaron 4,6 millones de nuevos casos de cáncer en China, lo que representa el 23,7% de los nuevos casos de cáncer a nivel mundial, según GLOBOCAN1.Además, en 2020 se atribuyeron aproximadamente 3 millones de muertes al cáncer en China, lo que representó el 30% de las muertes mundiales relacionadas con el cáncer1.Estas estadísticas indicaron que China ocupa el primer lugar en la tasa de incidencia y mortalidad del cáncer.Además, la tasa de supervivencia del cáncer a 5 años es del 40,5%, que es 1,5 veces menor que la tasa de supervivencia a 5 años en los Estados Unidos2,3.Las tasas de supervivencia comparativamente más bajas y las tasas de mortalidad más altas en China que en países con índices de desarrollo humano más altos sugieren que se necesita con urgencia un sistema de prevención y vigilancia del cáncer eficiente y rentable.La detección temprana del cáncer es uno de los elementos más críticos en un sistema de salud.La detección temprana del cáncer puede mejorar el pronóstico y la supervivencia en una etapa temprana en casi todos los tipos de cáncer4.Las estrategias de detección exitosas han llevado a una disminución significativa en las tasas de incidencia y mortalidad de los cánceres de cuello uterino, mama, colorrectal y próstata.
Sin embargo, lograr una detección temprana del cáncer no es una tarea fácil.Investigar la biología y el pronóstico del cáncer temprano, identificar y validar biomarcadores confiables de detección temprana y desarrollar tecnologías de detección temprana accesibles y precisas siempre han sido los mayores obstáculos en el proceso4.La detección precisa del cáncer puede distinguir las lesiones benignas de las malignas, lo que ayuda a evitar procedimientos innecesarios y facilita un mayor tratamiento de la enfermedad.Las estrategias actuales de detección temprana incluyen biopsias mediante endoscopio, imágenes médicas, citología, inmunoensayos y pruebas de biomarcadores5-7.Al ser intrusivas y costosas, las biopsias basadas en endoscopios conllevan una carga inherentemente pesada como procedimiento médico importante que depende de personal profesional.Al igual que la citología, ambos métodos de cribado dependen de los profesionales médicos y se basan en el criterio personal con un rendimiento que dista mucho de ser ideal8.Por el contrario, los inmunoensayos son muy inexactos, dadas las altas tasas de falsos positivos.Las imágenes médicas, como táctica de detección, requieren equipos costosos y técnicos especializados.Por lo tanto, las imágenes médicas son extremadamente limitadas debido a la baja accesibilidad.Por todo ello, los biomarcadores parecen ser una mejor opción para la detección temprana del cáncer.
Correspondencia a: Yinshan Li y Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 y
https://orcid.org/0000-0001-9920-1133
Recibido el 22 de agosto de 2023;aceptado el 12 de octubre de 2023;
publicado en línea el 28 de noviembre de 2023.
Disponible en www.cancerbiomed.org
©2023 Biología y medicina del cáncer.Bienes comunes creativos
Licencia Internacional Atribución-No Comercial 4.0
Actualmente, los biomarcadores se clasifican en proteínas, marcadores de mutación del ADN, marcadores epigenéticos, anomalías cromosómicas, marcadores de ARN derivados directamente de tumores o fragmentos de tumores obtenidos indirectamente de fluidos corporales.Los marcadores proteicos son los biomarcadores más utilizados en la detección y el diagnóstico del cáncer.Los biomarcadores proteicos, como biomarcadores de cribado, están limitados por la tendencia a verse afectados por lesiones benignas, lo que conduce a un sobrediagnóstico y un sobretratamiento, como se ha informado para la α-fetoproteína y el antígeno prostático específico (PSA)9,10.Los marcadores de ARN incluyen patrones de expresión genética y otros marcadores de ARN no codificantes. Se puede detectar una combinación de marcadores de ARN de expresión genética utilizando muestras de orina, cuya sensibilidad estaba lejos de ser satisfactoria (60%) para los tumores primarios, y cuya detección puede verse afectado por la naturaleza de fácil degradación del ARN en el ambiente normal11.Tanto los marcadores genéticos como los epigenéticos enfrentan el problema de la prevalencia en los tumores y la limitación a los tipos de cáncer.
La metilación del ADN ha sido un fuerte candidato como biomarcador de detección temprana desde que Feinberg la vinculó por primera vez con el cáncer en 198312. Las aberraciones de la metilación del ADN se observan en todas las etapas del cáncer, incluso en la etapa precancerosa.La hipermetilación aberrante del ADN suele tener lugar en las islas CpG de los promotores de genes para contrarrestar los supresores de tumores13,14.Los estudios también han sugerido que la hipermetilación anormal del ADN participa en la regulación positiva de los reguladores del desarrollo15.El valle de metilación del ADN, que comúnmente se asocia con reguladores del desarrollo y cánceres hipermetilados, podría cambiar el modo de expresión génica a un modo más estable dependiente de la metilación del ADN y disminuir la conexión con la histona metilada H3K27me3 y las proteínas policomb asociadas16,17.
Entre la gran cantidad de marcadores de metilación del ADN publicados, varios han debutado con éxito en el mercado;sin embargo, los marcadores de metilación del ADN y los paneles de diagnóstico comercializados actualmente aún tienen que desbloquear completamente el potencial de la detección temprana del cáncer por múltiples razones18.Si bien en su mayoría muestran un rendimiento aceptable utilizando información de bases de datos, estos biomarcadores generalmente funcionan de manera menos ideal en el mundo real debido al hecho de que las muestras del mundo real suelen ser más complejas y no tan representativas como las seleccionadas en las bases de datos.Se ha demostrado que la detección temprana de la metilación de múltiples cánceres basada en secuenciación de próxima generación tiene una sensibilidad de apenas el 16,8% y el 40,4% en los cánceres en estadio I y II, respectivamente19.Las pruebas de detección temprana requieren mayor estabilidad y biomarcadores más precisos.
Descubrimiento del marcador universal exclusivo para cáncer (UCOM) mediante secuenciación de posicionamiento de guía (GPS)
A pesar de décadas de investigación sobre el cáncer, no se han logrado una prevención y un tratamiento satisfactorios.Se necesitan nuevas metodologías que permitan a los investigadores evaluar exhaustivamente el cáncer.En los últimos 23 años, 6 características del cáncer, como evadir la apoptosis, invasión tisular y metástasis, etc., se han ampliado a 14 al incluir características como la reprogramación epigenética no mutacional y los microbiomas polimórficos20,21.A medida que se revelan más detalles sobre el cáncer, se introducen más perspectivas en la investigación del cáncer.La investigación del cáncer ha entrado gradualmente en una nueva era en dos direcciones (común e individualidad).Con el desarrollo de la oncología de precisión en los últimos años, el enfoque de la investigación del cáncer se está inclinando hacia la terapia dirigida individualizada y la heterogeneidad del cáncer22.Por lo tanto, los biomarcadores de cáncer identificados recientemente se han centrado principalmente en tipos de cáncer específicos, como el cáncer cervical forzado PAX623 y el BMP3 para el cáncer colorrectal24.El rendimiento de estos biomarcadores específicos de los tipos de cáncer varía, pero todavía no es posible que las personas susceptibles se sometan a pruebas de detección de todos los cánceres simultáneamente debido a la limitación de la adquisición de muestras biológicas y al alto costo.Sería ideal si pudiéramos identificar un biomarcador único y sólido que fuera eficaz para todos los tipos de cáncer en una etapa temprana.
Para lograr ese objetivo ideal, se debe seleccionar un mejor candidato a biomarcador de la lista de posibles tipos de biomarcadores.Se sabe que las aberraciones de metilación del ADN, entre todos los perfiles genéticos y epigenéticos, están relacionadas con el cáncer y son algunas de las primeras, si no las primeras, anomalías relacionadas con el cáncer que ocurren cronológicamente.La investigación de la metilación del ADN comenzó temprano, pero se vio obstaculizada por la falta de métodos de investigación.Entre los 28 millones de posibles sitios CpG metilados en el genoma, se debe detectar un número manejable y alinearlo con el genoma para comprender mejor la tumorigénesis.La secuenciación del genoma completo con bisulfito (WGBS), que se considera el estándar de oro de la secuenciación de la metilación del ADN, sólo puede cubrir el 50% de las C en las células cancerosas debido a la naturaleza del tratamiento con bisulfito que rompe fragmentos de ADN y reduce la complejidad del genoma durante el proceso. la transformación de Cs-a-Ts25.Otros métodos, como los chips de 450k, solo cubren el 1,6% de la metilación del genoma.Según 450.000 datos, un panel de detección de metilación del ADN tiene una sensibilidad del 35,4 % para 6 tipos de cánceres en estadio I26.Las limitaciones de los tipos de cáncer, el bajo rendimiento y el ruido generado por los métodos de detección en el proceso analítico se han convertido en los mayores obstáculos para los paneles de detección de cáncer.
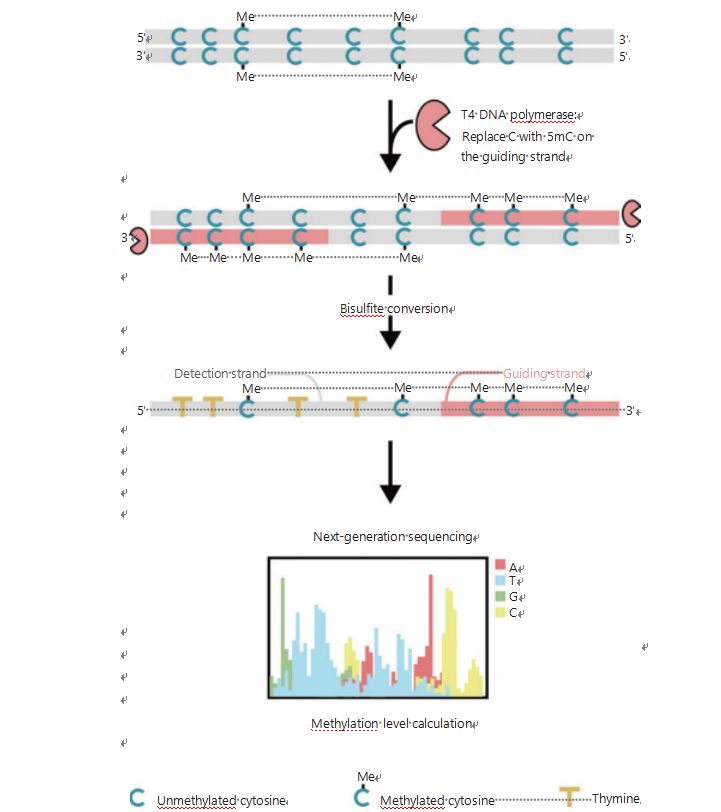
Para investigar mejor los patrones epigenéticos de las células durante la tumorigénesis y la metástasis, desarrollamos un GPS único para la detección de la metilación del ADN en todo el genoma, que cubre hasta el 96% de los sitios CpG en 400 millones de lecturas25.El GPS es un método de secuenciación bilateral que utiliza un extremo 3' de un fragmento de ADN de metilcitosinas no convertibles después del tratamiento con bisulfito que guía el alineamiento del cálculo de la metilación del ADN del extremo 5' mediante la secuenciación de pares de extremos (Figura 1)25.La cadena guía de metilcitosina, que actúa como cadena plantilla, ayuda en la alineación de la región con alto contenido de GC que recupera los datos de secuenciación más abandonados en la WGBS tradicional.La característica de alta cobertura del GPS proporciona una enorme cantidad de información sobre la metilación del ADN, lo que nos permite examinar los perfiles de metilación del cáncer con una resolución considerablemente mayor en regiones previamente poco investigadas.
El GPS nos proporciona una poderosa herramienta para investigar la homogeneidad del cáncer, lo que puede simplificar enormemente la investigación del cáncer y potencialmente encontrar una explicación universal para la tumorigénesis y la metástasis.Al analizar datos GPS de líneas celulares cancerosas, se encontró con frecuencia un fenómeno único.Había una serie de regiones que parecían estar anormalmente hipermetiladas en múltiples tipos de muestras de cáncer.Este hallazgo inesperado fue posteriormente validado para servir como UCOM.Se han analizado más de 7.000 muestras de 17 tipos de cáncer de la base de datos The Cancer Genome Atlas (TCGA), entre las que identificamos el primer UCOM, HIST1H4F, un gen relacionado con histonas que está hipermetilado en todos los tipos de cáncer27.Luego se encontraron y validaron una serie de UCOM en la base de datos TCGA, la base de datos Gene Expression Omnibus (GEO) y muestras clínicas del mundo real.Hasta ahora, HIST1H4F, PCDHGB7 y SIX6 han sido encontrados y validados como UCOM.El inesperado descubrimiento de los UCOM ofrece una poderosa respuesta a la necesidad de una detección temprana del cáncer.Los UCOM proporcionan una solución para la detección de marcadores únicos de múltiples cánceres.
Características de los UCOM
Tras la validación, se ha demostrado que los UCOM exhiben cuatro características principales que les permiten superar la eficacia de los biomarcadores actuales (Figura 2).
Exclusivo de la malignidad
Los UCOM son exclusivos de las lesiones cancerosas o precancerosas y no se ven afectados por los cambios fisiológicos normales.Algunos de los marcadores actuales relacionados con el cáncer que se han aplicado ampliamente en la detección temprana y/o el cribado han dado lugar a un sobrediagnóstico.Los niveles elevados de PSA, una herramienta de detección clínicamente acreditada, también se detectan en afecciones benignas, como la hiperplasia de próstata y la prostatitis10.El sobrediagnóstico y el consiguiente sobretratamiento conducen a una reducción de la calidad de vida debido a complicaciones intestinales, urinarias y sexuales28.Otros biomarcadores basados en proteínas y ampliamente utilizados en el ámbito clínico, como el CA-125, no han producido beneficios significativos y han provocado un sobrediagnóstico y un sobretratamiento29.La alta especificidad de los UCOM para las neoplasias malignas evita estas deficiencias.La UCOM, PCDHGB7, distingue eficientemente las lesiones intraepiteliales escamosas de alto grado (HSIL) y el cáncer de cuello uterino de muestras normales y las lesiones escamosas intraepiteliales de bajo grado (LSIL), mientras que la mayoría de los otros biomarcadores solo pueden diferenciar el cáncer de cuello uterino de muestras normales30.Aunque PCDHGB7 no detecta diferencias significativas entre el endometrio normal y la hiperplasia endometrial, se detectan diferencias significativas entre el endometrio normal y la hiperplasia atípica, y se detectan diferencias aún mayores entre el endometrio normal y el cáncer de endometrio (CE) según PCDHGB731.Los UCOM son exclusivos de las lesiones malignas en bases de datos y muestras clínicas.Desde la perspectiva del paciente, los UCOM únicos reducen el umbral para comprender indicaciones complejas de varios biomarcadores inestables de bajo rendimiento y la ansiedad correspondiente durante el proceso de evaluación.Desde la perspectiva del médico, UCOM únicos diferencian las neoplasias malignas de las lesiones benignas, lo que ayuda en la clasificación de los pacientes y reduce los procedimientos médicos innecesarios y el tratamiento excesivo.Por lo tanto, los UCOM exclusivos reducen la redundancia del sistema médico, alivian las dificultades del sistema y ponen a disposición más recursos médicos para quienes los necesitan.
Figura 1 Esquema del flujo de trabajo de GPS para la detección de metilación del ADN25.Línea gris: secuencia de ADN de entrada;línea roja: ADN tratado con ADN polimerasa T4, reemplazando la citosina con 5′-metilcitosina en el extremo 3′ de la entrada;azul C con Me: citosina metilada;azul C: citosina no metilada;T amarilla: timina25.
Todo o nada
Los UCOM sólo están presentes en las células cancerosas y se detectan de forma estable en casi todas las células cancerosas.Se validó que HIST1H4F estaba hipermetilado en casi todos los tipos de tumores, pero no en muestras normales27.De manera similar, también se ha demostrado que PCDHGB7 y SIX6 están hipermetilados en todas las muestras de tumores, pero no en muestras normales30-32.Esta característica única mejora significativamente el rendimiento de los UCOM con respecto al límite de detección y sensibilidad.Tan solo el 2% de las células cancerosas se pueden diferenciar en las muestras, lo que convierte a los UCOM en un biomarcador mucho más sensible que la mayoría de los biomarcadores existentes30. Como biomarcador utilizado para la detección del cáncer colorrectal, las mutaciones de KRAS solo existen en aproximadamente el 36% de los casos de cáncer colorrectal. lo que sugiere un potencial diagnóstico deficiente33.La baja prevalencia de mutaciones de KRAS en el cáncer colorrectal limita la combinación de KRAS con otros biomarcadores.De hecho, una combinación de biomarcadores puede parecer prometedora inicialmente, pero no siempre genera un resultado satisfactorio, aunque demuestra un ruido mucho mayor en el análisis de detección y, por lo general, implica procedimientos experimentales más complicados.Por el contrario, PCDHGB7 y otros UCOM existen en todos los cánceres.Los UCOM detectan componentes cancerosos en diferentes tipos de muestras de cáncer con la máxima precisión y al mismo tiempo erradican complejos procesos de análisis de cancelación de ruido.No es difícil detectar el cáncer en una muestra abundante, pero sí resulta extremadamente difícil detectar el cáncer en una muestra pequeña.Los UCOM son capaces de detectar pequeñas cantidades de cáncer.
Figura 2 Características de las UCOM.
Detección del cáncer que precede a los cambios patológicos.
Los UCOM se pueden detectar en la etapa precancerosa antes de los cambios patológicos.Como biomarcadores epigenéticos, las anomalías UCOM ocurren en una etapa más temprana que las anomalías fenotípicas y son detectables durante la tumorigénesis, progresión y metástasis34,35.La sensibilidad de UCOM con el tiempo mejora el rendimiento de UCOM en la detección de cáncer en etapa temprana y lesiones precancerosas.La detección temprana del cáncer basada en biopsias y citología puede resultar difícil incluso para los patólogos más experimentados.Se ha informado que una sola biopsia adquirida mediante colposcopia fue positiva en el 60,6 % de las muestras HSIL+.Se requieren biopsias adicionales en lesiones múltiples para aumentar la sensibilidad36.Por el contrario, la UCOM, PCDHGB7, tiene una sensibilidad del 82% para muestras HSIL+, superando la sensibilidad de las biopsias y la mayoría de los biomarcadores30.El marcador de metilación, FAM19A4, tiene una sensibilidad del 69% para CIN2+, que es similar a la citología, pero no puede diferenciar CIN1 de muestras normales37.Se ha demostrado que los UCOM son un biomarcador de detección temprana mucho más sensible.En comparación con los patólogos basados en la experiencia, los UCOM tienen una sensibilidad de detección superior para los cánceres en etapa temprana, lo que a su vez contribuye a mejorar el pronóstico y la supervivencia del cáncer30.Además, las UCOM ofrecen una plataforma de detección accesible para áreas que carecen de patólogos experimentados y mejora enormemente la eficiencia de la detección.Con procedimientos uniformes de muestreo y detección, la detección UCOM produce resultados estables y fáciles de interpretar que se adaptan mejor a un protocolo de detección que requiere menos personal profesional y recursos médicos.
Fácil de detectar
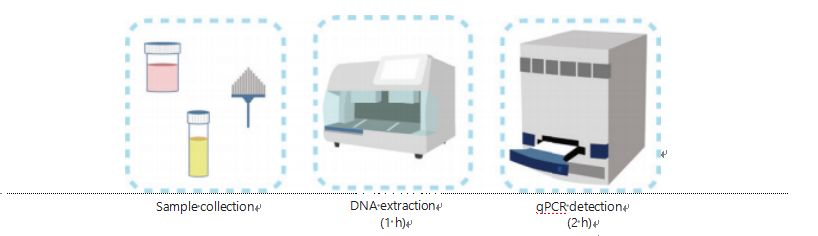
Los métodos actuales para la detección de la metilación del ADN son complicados y requieren mucho tiempo.La mayoría de los métodos requieren transformación con bisulfito, lo que provoca una pérdida en la calidad de la muestra y posiblemente produce resultados inestables e inexactos.La escasa reproducibilidad causada por el tratamiento con bisulfito potencialmente genera confusión para médicos y pacientes e interfiere aún más con el seguimiento y/o las estrategias de tratamiento.Por lo tanto, modificamos aún más el método de detección de UCOM para evitar el problemático tratamiento con bisulfito de las muestras, adaptarnos a los requisitos de la aplicación clínica y mejorar la accesibilidad.Desarrollamos un método novedoso que utiliza enzimas de restricción sensibles a la metilación combinadas con PCR cuantitativa fluorescente en tiempo real (Me-qPCR) para cuantificar el estado de metilación de los UCOM en 3 h utilizando procedimientos de fácil manejo (Figura 3).Me-qPCR puede acomodar múltiples tipos de muestras, como la recolección clínica de fluidos corporales y muestras de orina recolectadas por uno mismo.Las muestras clínicas recolectadas se pueden procesar, almacenar y proceder fácilmente a la detección mediante la extracción de ADN estandarizada y automatizada.Luego, el ADN extraído se puede aplicar directamente a la plataforma Me-qPCR para una reacción en un solo recipiente y generar resultados de cuantificación.Después de un simple análisis de resultados utilizando modelos de diagnóstico adaptados y validados para tipos de cáncer específicos, la determinación final de los resultados de detección de UCOM se interpreta y presenta como un valor semicuantitativo.La plataforma Me-qPCR supera a la tradicional pirosecuenciación con bisulfito en la detección UCOM y ahorra 3 h de conversión de bisulfito, según el protocolo del kit EZ DNA Mmethylation-Gold.La innovadora plataforma de detección de metilación hace que la detección UCOM sea más estable, más precisa y más accesible30.
Figura 3 Proceso de detección de UCOM.Los tipos de muestras incluyen BALF, cepillo de Papanicolaou y/o orina recolectada por usted mismo.El proceso de extracción de ADN se puede alojar en un extractor automático, cuyo producto puede detectarse directamente mediante qPCR.
Aplicación de las UCOM
Cáncer de pulmón
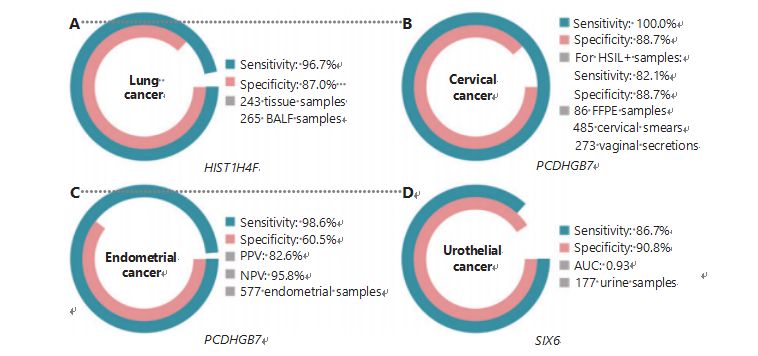
El cáncer de pulmón es el segundo cáncer más frecuentemente diagnosticado y más letal en todo el mundo, representando el 11,4% de los nuevos casos y el 18,0% de las nuevas muertes1.Entre todos los diagnósticos, el 85% son cáncer de pulmón de células no pequeñas (CPCNP) y el 15% son cáncer de pulmón de células pequeñas (SCLC), que tiene un mayor nivel de malignidad38.La tomografía computarizada de dosis baja (LDCT) es el método de detección recomendado actualmente para el cáncer de pulmón y se ha demostrado que mejora la detección temprana y reduce la mortalidad6;sin embargo, debido a la baja especificidad y la escasa accesibilidad, la LDCT aún no ha servido como método de detección satisfactorio, al igual que otros marcadores comunes de cáncer, como el CEA39.Los costos y la posibilidad de diagnósticos erróneos y erróneos de la estrategia de detección de LDCT impiden el progreso de la promoción de la detección del cáncer de pulmón40.HIST1H4F, un UCOM, tiene un enorme potencial como biomarcador de detección temprana en muestras de líquido broncoalveolar (BALF)27.HIST1H4F está hipermetilado en adenocarcinoma de pulmón y carcinoma de células escamosas de pulmón, con una especificidad de detección del 96,7% y una sensibilidad del 87,0% (Figura 4A), y un rendimiento excepcional para los cánceres en estadio I27.HIST1H4F tiene una especificidad del 96,5 % y una sensibilidad del 85,4 % para el NSCLC, y del 96,5 % y 95,7 %, respectivamente, para el SCLC27.Además, muestras de otros ocho tipos de cáncer, incluidos los cánceres de páncreas y colorrectal, han validado que HIST1H4F está hipermetilado en los ocho tipos27.
Cáncer de cuello uterino
El cáncer de cuello uterino fue el cuarto cáncer más frecuentemente diagnosticado y la cuarta causa principal de muerte por cáncer en mujeres en 2020, representando el 3,1% de los casos nuevos y el 3,4% de las muertes relacionadas con el cáncer a nivel mundial1.Para eliminar el cáncer de cuello uterino para 2030, como propone la OMS, la detección temprana del cáncer de cuello uterino es una necesidad.Si se detecta en una etapa temprana, la tasa de supervivencia a 5 años alcanza el 92% en el caso del cáncer de cuello uterino invasivo41.Las pautas de la Sociedad Estadounidense del Cáncer (ACS) sugieren pruebas de citología cervical, pruebas primarias de VPH o pruebas conjuntas para la detección42.La citología cervical es invasiva y sólo puede detectar el 63,5% de los casos NIC2+37.
PCDHGB7, por el contrario, ha funcionado mucho mejor utilizando pruebas de Papanicolaou y secreciones vaginales, y puede diferenciar eficientemente HSIL de LSIL en una etapa ultra temprana.PCDHGB7 por sí solo tiene una sensibilidad del 100,0 % y una especificidad del 88,7 % para el cáncer de cuello uterino (Figura 4B), y una sensibilidad del 82,1 % y una especificidad del 88,7 % para muestras HSIL+30.PCDHGB7 también tiene una sensibilidad del 90,9% y una especificidad del 90,4% en muestras de secreción vaginal para cáncer de cuello uterino, que son mucho más fáciles de recolectar30.Cuando se combina con la prueba de VPH de alto riesgo (hr) o la prueba de citología Thinprep (TCT), PCDHGB7 tiene una sensibilidad aumentada del 95,7% y una especificidad del 96,2%, superando significativamente la de la prueba de VPHhr (20,3%), TCT (51,2%). ), y los dos combinados (57,8%) para el cáncer de cuello uterino30.También se ha demostrado que PCDHGB7 está hipermetilado en 17 tipos de cáncer de la base de datos TCGA, lo que indica su idoneidad en la familia UCOM30.
Figura 4 Los UCOM se han validado en cuatro tipos de cáncer en estudios clínicos a gran escala.A. Rendimiento de HIST1H4F, una UCOM, en la detección de cáncer de pulmón de 508 muestras.B. Desempeño de PCDHGB7, una UCOM, en la detección de cáncer de cuello uterino de 844 muestras.C. Rendimiento de PCDHGB7, una UCOM, en la detección de cáncer de endometrio de 577 muestras de Papanicolaou y cepillo Tao endometrial.D. Desempeño de SIX6, una UCOM, en la detección de cáncer urotelial de 177 muestras.
EC
La CE es uno de los cánceres del sistema reproductivo femenino más comunes en todo el mundo, con aproximadamente 4,2 millones de casos nuevos y el 1% de las muertes relacionadas con el cáncer anualmente1.Con un diagnóstico exitoso en una etapa temprana, la AE es curable y tiene una tasa de supervivencia a 5 años del 95% para el cáncer en etapa I.Las pacientes sintomáticas, como sangrado uterino anormal, reciben evaluaciones clínicas periódicas y se someten a procedimientos de biopsia invasivos y dolorosos, a pesar de que solo entre el 5% y el 10% eventualmente desarrollan EC43.La ecografía transvaginal, como método de detección común, es muy poco confiable debido a su incapacidad para diferenciar los cambios endometriales benignos de los malignos y la alta tasa de falsos positivos44.
Se realizó una comparación paralela del CA-125 sérico, un biomarcador de CE ampliamente implementado, y PCDHGB7.El CA-125 sérico tuvo una sensibilidad del 24,8%, lo que sugiere que el CA-125 es un marcador inadecuado para la CE a pesar de una especificidad del 92,3%31.La detección de PCDHGB7 utilizando muestras con cepillo de Papanicolaou arrojó una sensibilidad del 80,65 % y una especificidad del 82,81 % para los estadios ECatall, mientras que un cepillo Tao tuvo una sensibilidad del 61,29 % y una especificidad del 95,31 %31.El modelo de diagnóstico PCDHGB7, basado en Me-qPCR, arrojó una sensibilidad del 98,61 %, una especificidad del 60,5 % y una precisión general del 85,5 %, utilizando muestras de Pap y Tao (Figura 4C)31.
Cáncer urotelial
El cáncer urotelial, compuesto por cánceres de vejiga, pelvis renal y uréter, fue el séptimo cáncer más frecuentemente diagnosticado en 2020 en todo el mundo, causando el 5,2% de los casos nuevos y el 3,9% de las muertes1.Los cánceres uroteliales, de los cuales más del 50 % son cáncer de vejiga, fueron el cuarto cáncer más frecuentemente diagnosticado en los Estados Unidos en 2022 y representaron el 11,6 % de los casos recién diagnosticados3.Aproximadamente el 75% de los cánceres de vejiga se clasifican como cáncer de vejiga no músculo-invasivo restringido a la mucosa o submucosa45.Una biopsia por cistoscopia es el estándar de oro para diagnosticar el cáncer urotelial implementado mediante hibridación fluorescente in situ (FISH) y pruebas de citología.La FISH y la citología tienen un rendimiento diagnóstico deficiente, y la cistoscopia es intrusiva y tiene el riesgo subyacente de pasar por alto microlesiones, malinterpretar las lesiones y causar potencialmente una diseminación o recaída del cáncer46.También se demostró que el UCOM previamente validado, PCDHGB7, está hipermetilado en el cáncer urotelial, con un área bajo la curva de 0,86, lo que sugiere una capacidad diagnóstica potencial30.Para validar aún más más UCOM y adaptarse mejor a más tipos de muestras, se examinó SIX6, un UCOM novedoso, que mostró un excelente potencial de diagnóstico en la detección temprana del cáncer urotelial utilizando muestras de orina en la plataforma Me-qPCR.La detección de SIX6 utilizando muestras de orina demostró una sensibilidad competitiva del 86,7 % y una especificidad del 90,8 % (Figura 4D), además de ser no invasiva y fácil de adquirir32.Actualmente se está investigando el potencial de SIX6 en el seguimiento de metástasis y la evaluación de la eficacia del tratamiento.
El futuro y los desafíos
Las UCOM tienen un sólido desempeño en el potencial de diagnóstico de múltiples cánceres, pero queda mucho trabajo por hacer.Hemos ido ampliando la lista de UCOM y hemos estado validando activamente las UCOM en más tipos de cáncer, incluidos aquellos que tradicionalmente son difíciles de detectar.Los resultados de validación de las bases de datos TCGA han corroborado aún más la aplicación de los UCOM en más tipos de cáncer y en más situaciones.En una investigación preliminar, se ha demostrado que los UCOM tienen un sólido potencial de diagnóstico para colangiocarcinomas y adenocarcinomas de páncreas, que son casi imposibles de diagnosticar en una etapa temprana con los métodos de detección actuales32,47.La capacidad de detectar cánceres raros con UCOM se puede utilizar con ADN tumoral circulante (ctDNA) mediante una plataforma de biopsia líquida mejorada48.Un estudio que incluyó un panel de detección de cáncer basado en ADN plasmático arrojó una sensibilidad del 57,9%49.A pesar de la alta especificidad, el rendimiento general revela que todavía hay margen de mejora.
Las características únicas de las UCOM también han respaldado la investigación del potencial de las UCOM en la evaluación de la eficacia del tratamiento y el seguimiento de la recurrencia.Según los Criterios de Evaluación de Respuesta en Tumores Sólidos (RECIST), las imágenes médicas son la metodología recomendada para el seguimiento de la recurrencia y la evaluación de la eficacia del tratamiento, mientras que los marcadores tumorales se utilizan solos para la evaluación50.En realidad, sin embargo, los métodos de imagen se ven muy afectados por la frecuencia y el momento y, por lo tanto, exponen a los pacientes a mayores riesgos y costos51,52.SIX6 ha sido validado para servir como predictor de metástasis de cáncer de mama32.La monitorización del ctDNA basada en biopsia líquida permite la vigilancia en tiempo real de una enfermedad residual mínima meses antes de la detección radiológica, lo que idealmente retrasa y previene la progresión del cáncer relacionada con la recaída53.Los resultados preliminares sugieren que los UCOM reflejan el nivel de hipermetilación cancerosa en tiempo real inmediatamente después de la cirugía y el tratamiento32.La alta sensibilidad exhibida por los UCOM y la aplicabilidad en múltiples tipos de muestras no invasivas permite que los UCOM sirvan como un biomarcador preciso de monitoreo de recurrencia mientras mantienen un alto cumplimiento por parte del paciente.
Al mismo tiempo, la accesibilidad pública a la prueba es otra cuestión importante que requiere esfuerzos adicionales.Si bien se han adoptado colaboraciones de detección de UCOM en más hospitales con la esperanza de beneficiar a más pacientes, se han realizado activamente detecciones y exámenes gratuitos en las zonas rurales de China.Los UCOM requieren una mejor accesibilidad para calificar como una herramienta de detección viable, especialmente para áreas subdesarrolladas.
Si bien los resultados de la aplicación UCOM en la detección temprana son prometedores, existen muchas incógnitas sobre UCOM.Con una exploración activa, se justifican investigaciones adicionales sobre por qué los UCOM están universalmente presentes en los cánceres.Los mecanismos de regulación epigenética subyacentes a las UCOM merecen una mayor investigación, lo que podría justificar una nueva dirección para la terapéutica del cáncer.Volviendo a la interacción entre la homogeneidad y la heterogeneidad del tumor, nos interesa saber por qué los UCOM pueden ser una excepción a la mayoría de los biomarcadores del cáncer que están estrechamente relacionados con tipos de cáncer específicos.El papel de las aberraciones de metilación del ADN identificadas por la UCOM en la tumorigénesis, la progresión tumoral y la metástasis no se ha determinado en el proceso de pérdida y recuperación de la identidad celular y requiere una inspección exhaustiva.Otro interés importante radica en el alcance de la incorporación del rasgo de homogeneidad de los UCOM con marcadores únicos de tejido con la esperanza de abordar la detección precisa de rastros de cáncer y la identificación de los orígenes del tejido tumoral de manera inversa.Los UCOM pueden ser una herramienta ideal para prevenir el cáncer, detectarlo y, potencialmente, defenderlo y eliminarlo.
Apoyo de subvención
Este trabajo fue apoyado por el Programa Nacional Clave de Investigación y Desarrollo de China (Subvención No. 2022BEG01003), la Fundación Nacional de Ciencias Naturales de China (Subvenciones No. 32270645 y 32000505), una subvención de la Comisión Provincial de Salud de Heilongjiang (Subvención No. 2020-111) y una subvención del Instituto de Ciencia y Tecnología de Heze (Subvención n.º 2021KJPT07).
Declaracion de conflicto de interes
Wei Li es el director de I+D de Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu forma parte del consejo asesor científico de Epiprobe.W. Yu y Epiprobe han aprobado patentes pendientes relacionadas con este trabajo.Todos los demás autores no declaran tener intereses en competencia.
Contribuciones de autor
Concibió y diseñó el proyecto: Chengchen Qian y Wenqiang Yu.
Escribió el periódico: Chengchen Qian.
Realizó las ilustraciones: Chengchen Qian.
Revisado y editado el manuscrito: Xiaolong Zou, Wei Li, Yinshan Li y Wenqiang Yu.
Referencias
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al.Estadísticas mundiales sobre el cáncer 2020: estimaciones de GLOBOCAN de
incidencia y mortalidad en todo el mundo por 36 cánceres en 185 países.CA Cáncer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Estadísticas de cáncer en China y Estados Unidos, 2022: perfiles, tendencias y determinantes.Chin MedJ (inglés).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Estadísticas de cáncer, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Detección temprana del cáncer.Ciencia.2022;375: fácil9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Estrategias para
Detección de cáncer colorrectal.Gastroenterología.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Detección de cáncer de pulmón.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et al.La perspectiva de la IARC sobre la detección del cáncer de cuello uterino.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Los desafíos de la colposcopia para la detección del cáncer de cuello uterino en los países de ingresos bajos y medianos y las soluciones mediante inteligencia artificial.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Biomarcadores circulantes en el diagnóstico y tratamiento del carcinoma hepatocelular.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Detección temprana del cáncer de próstata basada en PSA sérico en Europa y en todo el mundo: pasado, presente y futuro.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Desarrollo de una prueba de ARN múltiple en orina para la detección y estratificación del carcinoma de células transicionales de vejiga.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. La hipometilación distingue los genes de algunos cánceres humanos de sus contrapartes normales.Naturaleza.1983;301: 89-92.
13. Ng JM, Yu J. Hipermetilación del promotor de genes supresores de tumores como posibles biomarcadores en el cáncer colorrectal.IntJ Mol Ciencia.2015;16: 2472-96.
14. Esteller M. Epigenómica del cáncer: metilomas de ADN y mapas de modificación de histonas.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navegando por el panorama de la metilación del ADN del cáncer.Tendencias Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.Análisis epigenómico de la diferenciación multilinaje de células madre embrionarias humanas.Celúla.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Los análisis de todo el genoma revelan el papel de Polycomb en la promoción de la hipometilación de los valles de metilación del ADN.Genoma Biol.2018;19: 18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.Análisis de la metilación del ADN en el cáncer: ubicación revisada.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Validación clínica de una prueba de detección temprana de múltiples cánceres basada en metilación dirigida utilizando un conjunto de validación independiente.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Las características del cáncer.Celúla.2000;100: 57-70.
21. Hanahan D. Características del cáncer: nuevas dimensiones.Descubrimiento del cáncer.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Oncología de precisión: ¿quién, cómo, qué, cuándo y cuándo no?Libro Am Soc Clin Oncol Educ.2017: 160-9.
23. Liu H, Meng X, Wang J. Metilación cuantitativa en tiempo real
Detección del gen PAX1 en el cribado del cáncer de cuello uterino.Cáncer ginecológico IntJ.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Pruebas de ADN con múltiples objetivos para la detección del cáncer colorrectal.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Posicionamiento de guía
la secuenciación identifica patrones aberrantes de metilación del ADN que alteran la identidad celular y las redes de vigilancia inmune a tumores.genoma
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Detección no intrusiva de múltiples cánceres mediante secuenciación de metilación del ADN libre de células circulantes (THUNDER): desarrollo y estudios de validación independientes.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.Los genes relacionados con las histonas están hipermetilados en el cáncer de pulmón e hipermetilados
HIST1H4F podría servir como biomarcador pan-cáncer.Res. Cáncer.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Efectos sobre la calidad de vida de la detección del antígeno prostático específico.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Eficacia clínica de las pruebas de biomarcadores de detección del cáncer ofrecidas como servicio de salud de pago propio: una revisión sistemática.Eur J Salud Pública.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et al.
PCDHGB7 hipermetilado como marcador universal exclusivo de cáncer y su aplicación en la detección temprana del cáncer de cuello uterino.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et al.PCDHGB7 hipermetilado como biomarcador para la detección temprana de cáncer de endometrio en muestras de cepillo endometrial y raspados cervicales.Frente Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.Mutuamente
Modificación epigenética exclusiva en SIX6 con hipermetilación para estadio precanceroso y seguimiento de aparición de metástasis.Objetivo de transducción de señal Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. Mutación KRAS: de no farmacológico a farmacológico en el cáncer.Objetivo de transducción de señal Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.La metilación aberrante de p16 (INK4a) es un evento temprano en el cáncer de pulmón y un biomarcador potencial para el diagnóstico temprano.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.Metilación del ADN y enfermedades humanas.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Biopsias múltiples y detección de precursores de cáncer de cuello uterino en colposcopia.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Análisis de metilación del FAM19A4.
El gen en raspados cervicales es muy eficiente para detectar
carcinomas y lesiones NIC2/3 avanzadas.Cáncer Prev Res (Phila).2014;7: 1251-7.
38. AA tailandés, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Cáncer de pulmón.Lanceta.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Antígeno carcinoembrionario (CEA) como marcador tumoral en cáncer de pulmón.Cáncer de pulmón.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Detección de cáncer de pulmón, versión 3.2018, Pautas de práctica clínica en oncología de la NCCN.J Natl Compr Canc Netw.2018;16: 412-41.
41. Sociedad Estadounidense del Cáncer.Datos y cifras sobre el cáncer.Atlanta, GA, EE.UU.: Sociedad Estadounidense del Cáncer;2023 [actualizado el 1 de marzo de 2023;citado el 22 de agosto de 2023].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Detección de cáncer de cuello uterino para personas con riesgo promedio: actualización de las pautas de 2020 de la Sociedad Estadounidense del Cáncer.CA Cáncer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Asociación de riesgo de cáncer de endometrio con sangrado posmenopáusico en mujeres: una revisión sistemática y metanálisis.Médico Interno JAMA.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Sensibilidad del cribado por ecografía transvaginal.
para el cáncer de endometrio en mujeres posmenopáusicas: un estudio de casos y controles dentro de la cohorte UKCTOCS.Lanceta Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
Palou J, et al.Directrices de la Asociación Europea de Urología sobre el cáncer de vejiga no músculo-invasivo (TaT1 y carcinoma in situ) -
Actualización 2019.Euro Urol.2019;76: 639-57.
46. Aragón-Ching JB.Retos y avances en el diagnóstico, biología y tratamiento de los carcinomas uroteliales del tracto superior y de vejiga.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Colangiocarcinoma: conceptos y estrategias terapéuticas en evolución.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Biopsia líquida en hepatocelular
Carcinoma: células tumorales circulantes y ADN tumoral circulante.Cáncer de mol.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Pan-cáncer
Detección de ADN tumoral circulante en más de 10.000 pacientes chinos.Comuna Nacional.2021;12: 11.
50. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al.Nuevos criterios de evaluación de respuesta en tumores sólidos: guía RECIST revisada (versión 1.1).Eur J Cáncer.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - aprender del pasado para construir el futuro.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, Bogaerts J, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: directrices para los criterios de respuesta para su uso en ensayos
probar inmunoterapéuticos.Lanceta Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Biopsia líquida y enfermedad residual mínima: últimos avances e implicaciones para la cura.Nat Rev Clin Oncol.2019;16: 409-24.
Cite este artículo como: Qian C, Zou X, Li W, Li Y, Yu W. El puesto de avanzada contra el cáncer: marcadores universales exclusivos para el cáncer.Cáncer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Hora de publicación: 07-mayo-2024